Toxine botulique
| Toxine botulique | |
 | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.088.372 |
| Code ATC | M03 |
| DrugBank | BTD00092 |
| PubChem | 5485225 |
| Propriétés chimiques | |
| Formule | C6760H10447N1743O2010S32 |
| Masse molaire[1] | 149 320,833 ± 7,251 g/mol C 54,37 %, H 7,05 %, N 16,35 %, O 21,54 %, S 0,69 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Zn2+ |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La toxine botulique (ou botulinique, souvent désignée par le nom de marque lexicalisé botox) est une toxine sécrétée par Clostridium botulinum, la bactérie responsable du botulisme (toxi-infection alimentaire généralement contractée lors de la consommation de conserves avariées et responsable de paralysies musculaires). Il s'agit d'une protéine dont les propriétés neurotoxiques en font le plus puissant poison connu avec une DL50 estimée chez l'humain de l'ordre de 1 à 2 ng/kg. La toxine est thermolabile mais résistante aux acides et aux sucs digestifs.
Ses propriétés en font une arme biologique (toxine en aérosols), et à très faible dose un produit thérapeutique ou cosmétique.
Différents types de toxines botuliques
Sont distingués huit types de Clostridium botulinum qui diffèrent par les propriétés antigéniques des toxines qu'elles produisent : A, B, C1, C2, D, E, F et G. Ces huit toxinotypes sont associés à des protéines non toxiques (ANTPs)[2]. Le botulisme humain est associé aux types A, B et E et exceptionnellement aux types C et F alors que les types C et D sont essentiellement responsables du botulisme animal. Le botulisme de type A est le plus grave et est souvent mortel car la toxine correspondante est la plus active de toutes les toxines. Le type G a été retrouvé uniquement dans le sol[3]. Le type H découvert récemment est le plus meurtrier de tous et sa séquence est gardée secrète le temps de trouver un possible remède, le risque d'un détournement de la toxine étant trop élevé[4].
D'après leurs caractères phénotypiques, les souches de Clostridium botulinum sont distinguées en quatre groupes :
- les souches du groupe I sont protéolytiques et elles peuvent produire une toxine de type A, B ou F ou un mélange de toxines (A+B, A+F ou B+F) ;
- les souches du groupe II sont non protéolytiques et elles peuvent produire une toxine de type B, E ou F ;
- les souches du groupe III sont non protéolytiques et elles peuvent produire une toxine de type C ou D ;
- les souches du groupe IV sont protéolytiques, elles peuvent produire une toxine de type G.
Activité pharmacologique
| toxine botulique | |
| Informations générales | |
|---|---|
| Princeps |
|
| Identification | |
| No ECHA | 100.088.372 |
| Code ATC | M03AX01 |
La toxine botulique inhibe la libération de l'acétylcholine au niveau de la plaque motrice et au niveau du système nerveux parasympathique. Elle agit par paralysie des nerfs moteurs et provoque une paralysie flasque.
En temps normal, une cellule musculaire (myocyte) est stimulée lorsqu'elle reçoit un signal. Ce signal est transmis sous la forme d'un potentiel d'action qui migre le long d'un neurone : on parle d'influx nerveux. Au niveau de la synapse nerveuse, des vésicules d'acétylcholine fusionnent avec la membrane du neurone pour relâcher des molécules d'acétylcholine dans le milieu. Les cellules musculaires entrent en contraction tant que ces récepteurs membranaires reçoivent des molécules d'acétylcholine.
La toxine botulique agit au niveau de la fusion des vésicules d'acétylcholine avec la membrane de la cellule nerveuse en agissant sur le complexe SNARE. Le complexe SNARE permet la fusion entre la vésicule et la membrane pré-synaptique. Ainsi les récepteurs à acétylcholine des cellules musculaires restent vides et les muscles n'entrent pas en contraction. Ceci explique le phénomène de paralysie flasque observé chez les patients atteints de botulisme[3].
La toxine botulique est l'un des poisons les plus violents connus à ce jour. La DL50 a été évaluée à 1 ng kg−1[5] : estimée chez l'humain entre 1,3 et 2,1 ng/kg par voie intraveineuse ou intramusculaire et entre 10 et 13 ng/kg par inhalation[6] (soit plus de 500 000 fois inférieure à celle du cyanure et plus de 2 000 fois inférieure à celle du gaz VX). La toxine est thermolabile mais résistante aux acides et aux sucs digestifs.
Un milligramme de toxine pure suffirait à causer la mort de trente à quarante millions de souris, soit une masse d'environ 1 500 à 2 000 tonnes.
Structure de la toxine botulique
Structure générale
La toxine est un polypeptide à deux chaînes, une lourde (H : Heavy) et une légère (L : Light). La chaîne lourde de 100 kDa est liée à une chaîne légère de 50 kDa par un pont disulfure. La chaîne lourde lie la molécule de toxine sur le récepteur neuronal et permet alors la translocation de la chaîne légère, qui porte l'activité enzymatique de la molécule de toxine. Cette chaîne légère est une protéase, enzyme qui attaque le complexe SNARE aux jonctions neuromusculaires, empêchant des vésicules de fusionner à la membrane pour libérer l’acétylcholine[7].
La toxine est synthétisée sous forme d’un monomère d'un poids moléculaire de 150 kDa, elle est inactive sous cette forme. Ce monomère est composé de trois domaines : un domaine avec une activité protéase (endopeptidase à zinc), un domaine de translocation et un domaine de liaison. Le domaine de translocation est responsable de la translocation de la chaîne légère qui possède l’activité protéase dans le cytoplasme de la synapse du neurone cible. Le domaine de liaison est composé de deux sous-domaines de taille équivalente. Le sous-domaine HC-N a une structure similaire aux protéines qui lient les sucres. Le sous-domaine HC-C est replié de façon similaire aux protéines connues pour être impliquées dans des fonctions de liaison protéine/protéine. Ce motif contient plus précisément une structure en β-trefoil qui est présente dans plusieurs protéines impliquées dans la reconnaissance et la liaison de protéines comme IL-1, des facteurs de croissance ou d’inhibiteur de trypsine… Une telle structure va permettre la liaison avec la membrane pré-synaptique par l’intermédiaire d’une double interaction entre deux molécules différentes[8].
La chaîne inactive de 150 kDa de la neurotoxine est activée par une protéolyse spécifique de la boucle exposée qui contient le pont disulfure reliant la chaîne légère et la chaîne lourde. Plusieurs protéinases endogènes (de la bactérie) ou exogènes (des tissus) peuvent aussi bien activer cette toxine. La chaîne lourde et la chaîne légère restent associées par des liaisons non covalentes de type protéine/protéine et par le pont disulfure au niveau de la boucle de clivage. Pour que le site actif situé sur la chaîne légère soit opérationnel, il faudra rompre le pont disulfure. Cela est réalisé au moment de la translocation[8].
La suite de l'article s'intéresse plus particulièrement à la toxine botulique B (BoNT/B).
Liaison de la toxine botulique sur la synapse neuronale
Des études ont démontré la fixation de la BoNT/B sur la synaptotagmine. Notamment des études de cristallographie montrant la liaison de la BoNT/B sur la partie extracellulaire de la synaptotagmine par l’intermédiaire d’un ganglioside. C’est la chaine lourde qui possède le domaine de liaison à la synaptotagmine[9],[10].
Internalisation de la toxine dans la synapse
Des études d’immunofluorescence ont montré que la toxine et la synaptotagmine sont co-internalisées par endocytose lorsque cette première est recyclée par la cellule[11].
Translocation de la chaîne légère de la toxine dans le cytosol de la synapse
La BoNT/B va donc se retrouver dans une vésicule de la cellule. Ces vésicules vont former un endosome qui va s’acidifier grâce à des pompes à protons. Cette acidification va provoquer un changement de conformation du domaine de translocation (N-Terminal) de la chaîne lourde de la toxine, ce qui facilite la libération de la chaîne légère dans le cytoplasme. Plus précisément, la baisse du pH permet aux chaînes lourdes de former un tétramère qui s’insère dans la membrane de la vésicule pour former des pores. Ce sont sept hélices du domaine de translocation qui permettent la formation de ces pores qui permettront à la chaîne légère de traverser la bicouche lipidique. En effet, l’acidification de la vésicule provoque également la dénaturation de la chaîne légère qui passe d'une forme hydrophile globulaire à une forme globulaire fondue dont les segments hydrophobes sont exposés en surface ce qui permet son insertion. La chaîne légère se détache de la chaîne lourde par réduction du pont disulfure. Ce fondue globulaire a un diamètre inférieur au diamètre du pore formé par la chaîne lourde (15 Å). Après exposition au pH neutre du cytosol, la chaîne légère se renature dans le cytosol et retrouve son activité endopeptidase. Ces observations sur la translocation de la BoNT/A peuvent être appliquées aux autres sérotypes de la toxine botulique[12],[13],[14],[15],[7].
Action de la toxine botulique sur le complexe SNARE
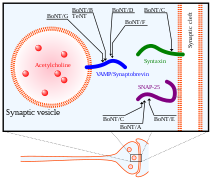
La toxine botulique, une fois entrée dans le cytoplasme de la synapse, va se fixer à sa cible : le complexe SNARE. Les différentes toxines (A à H) agissent sur des protéines différentes ou sur des parties différentes des protéines du complexe SNARE.
Activité endopeptidase à zinc de la toxine botulique
La toxine botulique est une endopeptidase à zinc. Une comparaison de séquence a montré une séquence hautement conservée de 20 acides aminés localisés dans le milieu de la chaîne légère. Cette séquence contient le motif d’une endopeptidase à zinc : His–Glu–Xaa–Xaa–His. Ce motif lie un atome de zinc. Des mesures physicochimiques ont montré que ces neurotoxines contiennent une seule molécule de zinc par toxine (sauf le BoNT/C qui en contient deux) qui lie la chaîne légère. Des modifications chimiques et des expériences de mutagénèse dirigée avec ces neurotoxines ont montré que deux résidus d’histidine et un résidu de glutamate sont des ligands de l’atome de zinc. Ce zinc est coordonné par l’His 229, l’His 233 et le Glu 267 chez BoNT/B. Un quatrième ligand : une molécule d’eau permet l’hydrolyse de la liaison peptidique du substrat. Des molécules de calcium ont également un rôle dans l’activité de ces toxines.
Plus précisément, le domaine catalytique est un globule compact composé d’un mélange d’hélices α et de feuillets β. L’atome de zinc est situé à l’intérieur d’une grande cavité ouverte qui possède un potentiel électrostatique négatif élevé. Ce site catalytique est protégé par deux régions ceintures de part et d’autre de la cavité. Ce site catalytique est également protégé par le domaine de translocation lorsque celui-ci est relié à la chaîne légère[8],[16],[7].
Cette activité endoprotéique dénature la protéine SNAP-25 (de la famille des SNARE) à laquelle la toxine botulique s'est liée. Ainsi modifiée, la protéine SNAP-25 bloque la fusion de la vésicule synaptique contenant l'acétylcholine avec la membrane plasmique du bouton terminal de l'axone : le neurotransmetteur n'étant plus libéré dans la fente synaptique, l'activité synaptique diminue au point de devenir nulle, provoquant ainsi les symptômes d'atonie musculaire propres au botulisme.
Utilisations thérapeutiques
La toxine à visée thérapeutique ou cosmétique, est utilisée à doses trop faibles pour causer des troubles. Il existe toutefois un botulisme iatrogénique, à la suite d'accident (erreur de dosage) ou de surdosage de produits non homologués[17].
Strabisme, nystagmus, blépharospasme, torticolis
Depuis la fin des années 1970 la toxine botulique est parfois utilisée en cas de strabisme, de nystagmus, de blépharospasme, voire de torticolis récalcitrant[18].
Dystonie
La toxine botulique est également utilisée dans le traitement d'une maladie rare ou orpheline appelée dystonie. Cette maladie d'origine neurologique frappe certains points du corps comme le cou — on parle alors de torticolis spasmodique —, les paupières (blépharospasme), dysphonie spasmodique…[19],[20].
La toxine a une action sur les troubles de la motricité notamment sur la spasticité. Elle est utilisée sous forme d'injection dans le point moteur du muscle entraînant une paralysie du muscle permettant de réduire les contractions excessives liés à la spasticité[19].
Transpiration et bavage
On utilise aujourd'hui également la toxine botulique pour traiter les problèmes de transpiration excessive (hyperhidrose)[18],[21] et de bavage (hypersialorrhée)[22] grâce à l'action de la toxine sur les récepteurs du réseau parasympathique.
Syndrome des loges
Les injections de toxines botuliques A peuvent également être utilisées en médecine du sport afin de traiter les syndromes des loges[23]. Les toxines entraînent en effet à faible concentration une faiblesse musculaire, suivie par la suite d'une fonte musculaire permettant de recréer un espace au sein de la loge pathologique. Ces injections ont donc l'intérêt d'éviter ou de repousser des aponévrotomies douloureuses pour les personnes atteintes de cette pathologie.
Migraine
Certaines études suggèrent que des injections de toxine botulique dans certains muscles de la tête et du cou sont efficaces pour traiter les douleurs de la migraine mais ces résultats ont été infirmés[24] en prouvant par un essai clinique en double aveugle que c’est l’effet placebo qui explique certains résultats positifs. Selon Maja Relja, les patients « considèrent inconsciemment qu’une injection a forcément plus d’effets analgésiques qu’un comprimé[24]. »
Bruxisme
Chez les bruxomanes, son utilisation[25] permet le déconditionnement de la praxie et par la baisse de force musculaire induite par le traitement des douleurs associées : céphalée de tension (pas migraine), douleur de l'articulation temporo-mandibulaire, et ses complications, fractures des couronnes, atteinte parodontale…
Syndrome CHARGE
La toxine botulique a été utilisée avec succès[26] sur des nouveau-nés pour traiter un excès de production de salive induit par une maladie génétique rare, le syndrome CHARGE.
Affections gastro-entérologiques
La toxine botulique peut être utilisée pour remédier à une dysphagie, une achalasie, une sténose hypertrophique du pylore, une sténose du sphincter d'Oddi, la maladie de Hirschsprung, un dysfonctionnement rétrograde du muscle cricopharyngé (en) (R-CPD), une fissure anale, des hémorroïdes, en proctologie[18].
Affections urologiques
La toxine botulique peut être utilisée en cas de vessie hyperactive, de dysynergie vésico-sphinctérienne[18].
Utilisations cosmétiques
La toxine botulique est utilisée en injections locales à faible dose pour provoquer des paralysies musculaires ciblées (muscles peauciers du front par exemple) afin d'atténuer temporairement les rides (pendant cinq à six mois). En géneral, on traite les rides dites du Lion (muscle corrugator et pyramidal), le muscle frontal, les fibres externes du muscle orbiculaire (rides dites de la patte d'oie).
L'application esthétique de la toxine botulique a été découverte par hasard à la fin des années 1980[18]. Le Dr Jean Carruthers, ophtalmologiste, traitant une patiente pour blépharospasme, constate une atténuation des rides de la glabelle. Elle poursuit des recherches avec son époux qui est dermatologue, le Dr Alastair Carruthers. Leur première présentation à un congrès scientifique de l'usage du produit à des fins esthétiques est fort mal reçue. L'utilisation esthétique de la toxine botulique est par la suite devenue un véritable phénomène de société aux États-Unis, et a fait la fortune du laboratoire Allergan, qui commercialise le Botox. D'autres appellations commerciales sont également utilisées, comme le Dysport (Laboratoire Ipsen), le Vistabel, le Bocouture ou le Xeomin.
Les injections de toxine botulique sont souvent associées aux injections d'acide hyaluronique. Les premières ont un effet tenseur de la peau (elles détendent le muscle) alors que les secondes ont pour effet de combler les rides. Il est souvent utile d'utiliser les deux techniques pour traiter l'ensemble d'un visage.
Les injections agissent uniquement sur les rides dynamiques, ou rides d'origine musculaire, et ont un effet de mise au repos des muscles ciblés[27].
Arme biologique
Données historiques
Dans les années 1930, l'Unité 731 (unité japonaise de guerre biologique) cultive le Clostridium botulinum pour en étudier l'effet sur des prisonniers durant l'occupation de la Mandchourie[6].
Durant la Seconde Guerre mondiale, selon une hypothèse évoquée par certains historiens[28], Reinhard Heydrich, un dignitaire nazi qui fut l'adjoint direct de Heinrich Himmler, pourrait avoir été victime d'une arme biologique antipersonnel fondée sur l'utilisation de la toxine botulique. L'Obergruppenführer, atteint par des fragments d'une grenade lancée contre lui par des résistants tchèques (opération Anthropoid), est mort alors que le pronostic vital n'était pas engagé, peut-être du botulisme[29], provoqué par la toxine botulique mêlée à la couche de colle enduisant la grenade.
Durant le même conflit, les États-Unis produisent eux-mêmes de la toxine botulique, des milliers de bombes à anthrax et à toxine botulique seront produites (dénommées respectivement « agent N » et « agent X »). Le but est d’anéantir l’Allemagne en larguant des centaines de milliers de ces bombes[30] sur six villes sélectionnées, Aix-la-Chapelle, Wilhelmshaven, Stuttgart, Francfort, Hambourg et Berlin. Ce projet génocide sera annulé après le succès du débarquement en Normandie. Plus d'un million de doses d'antitoxines ont été mises à disposition des troupes.
En 1969-1970, le président Richard Nixon met fin au programme américain des armes offensives biologiques.
En 1972, une convention internationale interdit la recherche, la production et la détention d'armes biologiques offensives, la Biological and Toxin Weapons Convention, mais des pays signataires ne respectent pas leur engagement, comme l'Irak ou l'Union soviétique. La toxine botulique est ainsi testée sur le site soviétique dit Aralsk-7 sur l'île de Vozrojdénia dans la mer d'Aral.
En 1991, après la guerre du Golfe, un rapport du Département de la Défense américaine soutient que l'Irak aurait reconnu devant les experts de l'ONU, avoir produit 19 000 litres de toxine botulique concentrée, dont près de 10 000 étaient militarisés (armes chargées)[6],[31]. En 1990, l'Irak aurait déployé treize missiles de 600 km de portée et cent bombes de 180 kg, chargés de toxine botulique[6].
Entre 1990 et 1995, plusieurs tentatives d'attaques par aérosol de toxine botulique ont eu lieu au Japon, menées par la secte Aum Shinrikyô. Les auteurs auraient obtenu leur C. botulinum à partir de sols prélevés dans le nord du Japon, mais ils auraient échoué à obtenir un aérosol efficace.
En 2001, le gouvernement américain liste quatre pays comme développant, ou soupçonnés de développer, la toxine botulique comme arme biologique : Iran, Irak, Corée du Nord et Syrie[6].
Données récentes
Des experts mettent en doute l'efficacité militaire d'éventuels aérosols de toxine botulique, à cause des contraintes liées à la concentration et à la stabilisation de la toxine (contradictoire avec la dissémination). D'autres estiment qu'un aérosol à partir d'un point source, pourrait contaminer 10 % des personnes dans un rayon de 0,5 km sous le vent[6]. D'autres moyens sont envisagés, afin d'y faire face, comme la contamination délibérée d'aliments ou d'un réseau d'eau potable.
En situation naturelle, on ne connaît aucun cas de botulisme humain lié à l'eau. En principe, la chloration de l'eau inactive la toxine. Cependant en cas d'alerte, des kits de détection pour eau d'alimentation sont prévus. La toxine est détruite par ébullition pendant dix minutes[32].
Selon le plan Biotox, les données inhabituelles, pouvant évoquer une malveillance ou un acte bioterroriste, lors de cas de botulisme, ont été définies : très nombreux cas localisés dans le temps et l'espace (aéroport, lieu de travail, lieu d'habitation, même réseau d'eau...), foyers simultanés sans source commune, une toxine de type inhabituel pour la région ou les circonstances[33].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Stéphanie Raffestina, Jean Christophe Marvauda, Rosario Cerratoa, Bruno Dupuyb, Michel R. Popoff, « Organization and regulation of the neurotoxin genes in Clostridium botulinum and Clostridium tetani », Anaerobe, 2004 (10), 93-100.
- (en) Miia Lindström and Hannu Korkeala, « Laboratory Diagnostics of Botulism », Clinical Microbiology Reviews, 2006 (19), 298-314.
- ↑ (en) « New botox super-toxin has its details censored »
- ↑ (en) Diane O. Fleming et Debra Long Hunt, Biological Safety: principles and practices, ASM Press, 2000, p. 267.
- Stephen S. Arnon, Schechter R. et Inglesby T.V., « Botulinum Toxin as a Biological Weapon: Medical and Public Health Management », Journal of the American Medical Association, vol. 285, no 8, , p. 1059–1070 (PMID 11209178, DOI 10.1001/jama.285.8.1059, lire en ligne [PDF]).
- (en) Subramanyam Swaminathan et Subramaniam Eswaramoorthy, « Structural analysis of the catalytic and binding sites of Clostridium botulinum neurotoxin B », Nature Structural Biology, 2000 (7), 693-9.
- (en) Giampietro Schiavo, Michela Matteoli et Cesare Montecucco, « Neurotoxins affecting neuroexocytosis », Physiological Reviews, 2000 (80), 718-66.
- ↑ (en) Qing Chai, Joseph W. Arndt, Min Dong, William H. Tepp, Eric A. Johnson, Edwin R. Chapman et Raymond C. Stevens, « Structural basis of cell surface receptor recognition by botulinum neurotoxin B », Nature, 2006 (444), 1096-100.
- ↑ (en) Rongsheng Jin, Andreas Rummel, Thomas Binz et Axel T. Brunger, « Botulinum neurotoxin B recognizes its protein receptor with high affinity and specificity », Nature, 2006 (444), 1092-5.
- ↑ (en) Min Dong, David A. Richards, Michael C. Goodnough, William H. Tepp, Eric A. Johnson et Edwin R. Chapman, « Synaptotagmins I and II mediate entry of botulinum neurotoxin B into cells », The Journal of Cell Biology, 2003 (162), 1293–303.
- ↑ (en) David H. Hoch, Miryam Romero-Mira, Barbara E. Ehrlich, Alan Finkelstein, Bibhuti R. Dasgupta et Lance L. Simpson, « Channels formed by botulinum, tetanus, and diphtheria toxins in planar lipid bilayers: Relevance to translocation of proteins across membranes », Proc. Nati. Acad. Sci, 1985 (82), 1692-6.
- ↑ (en) Lilia K. Koriazova et Mauricio Montal, « Translocation of botulinum neurotoxin light chain protease through the heavy chain channel », Nature structural biology, 2003 (10), 13-8.
- ↑ (en) Paula F. Flicker, John P. Robinson et Bibhuti R. DasGupta, « Is formation of visible channels in a phospholipid bilayer by botulinum neurotoxin type B sensitive to its disulfide? », Journal of Structural Biology, 1999 (128), 297–304.
- ↑ (en) Shuowei Cai, Roshan Kukreja, Sue Shoesmith, Tzuu-Wang Chang et Bal Ram Singh, « Botulinum neurotoxin light chain refolds at endosomal pH for its translocation », The Protein Journal 2006 (25), 455-62.
- ↑ (en) Subramaniam Eswaramoorthy, Desigan Kumaran, James Keller et Subramanyam Swaminathan, « Role of metals in the biological activity of Clostridium botulinum Neurotoxins », Biochemistry, 2004 (43), 2209-16.
- ↑ Botulism, « J. Sobel », Clinical Infectious Diseases, , p. 1168-1169
- Campanelli A, Salomon D, « Hyperhidrose localisée : clinique et traitements [Focal hyperhidrosis: disease characteristics and treatments] », Rev Med Suisse, vol. 5, no 200, , p. 870-5. (PMID 19438086, lire en ligne [html])
- M. Vidailhet, « La toxine botulique en neurologie », La Revue de Médecine Interne, vol. 26, no 7, , p. 531–533 (ISSN 0248-8663, DOI 10.1016/j.revmed.2005.04.035, lire en ligne, consulté le )
- ↑ « Dystonie : symptômes, c'est quoi cette maladie du mouvement ? », sur sante.journaldesfemmes.fr, (consulté le ).
- ↑ (en) Lakraj AA, Moghimi N, Jabbari B, « Hyperhidrosis: anatomy, pathophysiology and treatment with emphasis on the role of botulinum toxins », Toxins (Basel), vol. 5, no 4, , p. 821-40. (PMID 23612753, PMCID PMC3705293, DOI 10.3390/toxins5040821, lire en ligne [html])
- ↑ (en) Lakraj AA, Moghimi N, Jabbari B, « Sialorrhea: anatomy, pathophysiology and treatment with emphasis on the role of botulinum toxins », Toxins (Basel), vol. 5, no 5, , p. 1010-31. (PMID 23698357, PMCID PMC3709276, DOI 10.3390/toxins5051010, lire en ligne [html])
- ↑ Léna Claudel (dir.), Syndrome des loges chroniques : une revue systématique de la littérature des prises en charges non chirurgicales (HAL dumas-03652267, lire en ligne), p. 42-50.
- (en) Relja M, Poole AC, Schoenen J, Pascual J, Lei X, Thompson C; European BoNTA Headache Study Group, « A multicentre, double-blind, randomized, placebo-controlled, parallel group study of multiple treatments of botulinum toxin type A (BoNTA) for the prophylaxis of episodic migraine headaches », Cephalalgia, vol. 27, no 6, , p. 492-503. (PMID 17428299)
- ↑ (en) Van Zandijcke M, Marchau MM, « Treatment of bruxism with botulinum toxin injections », J Neurol Neurosurg Psychiatry, vol. 53, no 6, , p. 530. (PMID 2380736, PMCID PMC1014218)
- ↑ Docteur Sam Daniel, directeur adjoint de recherche de la division d'oto-rhino-laryngologie de l'Hôpital de Montréal pour enfants du Centre universitaire de santé McGill, et professeur agrégé de l'Université McGill.
- ↑ Dr Joel Aknin, « Injection de Botox / Toxine Botulique à Lyon », Esthétique Médicale, (lire en ligne, consulté le ).
- ↑ Elle est notamment développée par Patrick Berche dans son ouvrage L'histoire secrète des armes biologiques. Mensonges et crimes d'État (Éditions Robert Laffont, 2009, p. 65).
- ↑ Quelques heures avant de mourir, Heydrich présente les symptômes du botulisme, à savoir la « paralysie progressive des muscles des membres, des muscles du thorax, de la face et de la gorge » (Ibid., p. 65).
- ↑ Luciano Paolozzi, Jean-Claude Liébart et Philippe Sansonetti, Microbiologie : biologie des procaryotes et de leurs virus, Paris, Dunod, dl 2015, cop. 2015, 512 p. (ISBN 978-2-10-072081-1, OCLC 909812860, lire en ligne).
- ↑ La source Arnon 2001 donne comme sources primaires : le 10e rapport du Conseil de sécurité de l'ONU 1991, à propos des résolutions 687 et 699.
- ↑ Direction générale de la Santé, « Botulisme, plan Biotox », La Revue du Praticien - médecine générale, , p. 1991-1992
- ↑ S. Haeghebaert, « Caractéristiques épidémiologiques du botulisme humain en France », Bulletin épidémiologique hebdomadaire, , p. 129-130.
Voir aussi
Articles connexes
Bibliographie
- (en) Carruthers A. et Carruthers J.D.A., « The Treatment of Glabellar Furrows with Botulinum-A Exotoxin », Movement Disorders, 1990, 16:83.
Liens externes
- BotDB : base de données américaines sur les neurotoxines des Clostridiums
- Page spécifique, sur Le Vidal.fr
- Compendium suisse des médicaments : spécialités contenant Toxine botulique
