Tétraiodure de tellure
| Tétraiodure de tellure | |
 Crédit image:
licence CC BY-SA 4.0 🛈 | |
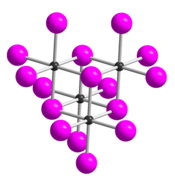
| Structure du tétramère (TeI4)4 __ Te4+ __ I− |
|
| Identification | |
|---|---|
| Synonymes |
iodure de tellure(IV) |
| No CAS | |
| No ECHA | 100.029.282 |
| No CE | 232-210-5 |
| PubChem | 82255 |
| SMILES | |
| InChI | |
| Apparence | solide cristallisé à l'odeur âcre[1] |
| Propriétés chimiques | |
| Formule | I4Te |
| Masse molaire[2] | 635,22 ± 0,03 g/mol I 79,91 %, Te 20,09 %, |
| Propriétés physiques | |
| T° fusion | 280 °C[1] |
| Solubilité | Réagit au contact de l'eau[1] |
| Masse volumique | 5,403 g·cm-3[1] |
| Précautions | |
| SGH[1] | |
| H302, H312, H314, H332, P260, P301+P330+P331, P303+P361+P353, P305+P351+P338, P405 et P501 |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le tétraiodure de tellure est un composé chimique de formule TeI4. Il se présente sous la forme d'un solide gris métal qui se décompose lentement dans l'eau froide et rapidement dans l'eau chaude en donnant du dioxyde de tellure TeO2 et de l'iodure d'hydrogène HI. Il est constitué de tétramères différents de ceux observés dans le TeCl4 et le TeBr4 ; les atomes de tellure sont coordonnés avec une géométrie octaédrique dans laquelle les sommets des octaèdres sont communs[3]. Il reste stable dans l'air humide et se décompose sous l'effet de la chaleur en libérant de l'iode I2. Il est soluble dans l'acide iodhydrique HI(aq) en formant l'espèce H[TeI5] et est légèrement soluble dans l'acétone CH3COCH3. À l'état liquide, c'est un conducteur de l'électricité par l'intermédiaire des ions TeI3+ et I−. À l'état gazeux, il se dissocie en diiodure de tellure TeI2 et iode[4] I2.
On peut obtenir du tétraiodure de tellure en faisant réagir de l'acide tellurique Te(OH)6 avec de l'iodure d'hydrogène HI :
On peut également le produire à partir des éléments eux-mêmes, mais cette réaction donne également du diiodure de tellure TeI2 et du monoiodure de tellure TeI selon les conditions de réaction[5] :
Une autre façon de procéder consiste à faire réagir du tellure avec de l'iodométhane CH3I[3].
Les solvants avec des propriétés donneuses comme l'acétonitrile CH3CN forment des complexes ioniques qui rendent la solution conductrice :
Notes et références
- « Fiche du composé Tellurium(IV) iodide, 99% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997. (ISBN 0-08-037941-9)
- (en) Arnold Frederik Holleman et Egon Wiberg, Inorganic Chemistry, revu par Nils Wiberg, traduit par Mary Eagleson et William Brewer, Academic Press/De Gruyter, San Diego/Berlin, 2001. (ISBN 0-12-352651-5)
- (en) J. J. Zuckerman, Inorganic Reactions and Methods, The Formation of Bonds to Halogens, John Wiley & Sons, 2009, p. 59. (ISBN 0-470-14538-2)




