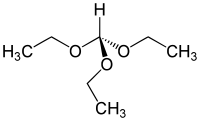
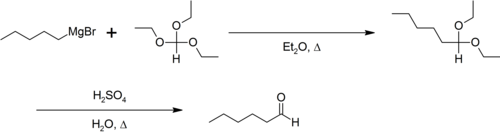Orthoformiate d'éthyle
| Orthoformiate d'éthyle | |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | (diéthoxyméthoxy)éthane | ||
| Synonymes |
triéthoxyméthane, orthométhanoate d'éthyle |
||
| No CAS | |||
| No ECHA | 100.004.138 | ||
| No CE | 204-550-4 | ||
| No RTECS | RM6475000 | ||
| PubChem | 31214 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C7H16O3 [Isomères] |
||
| Masse molaire[1] | 148,200 1 ± 0,007 6 g/mol C 56,73 %, H 10,88 %, O 32,39 %, |
||
| Propriétés physiques | |||
| T° fusion | −76 °C[2] | ||
| T° ébullition | 146 °C[2] | ||
| Masse volumique | 0,891 g·cm-3 à 25 °C[2] | ||
| Point d’éclair | 35 °C[2] | ||
| Pression de vapeur saturante | 2,9 mmHg (20 °C)[2] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,391[2] | ||
| Précautions | |||
| SGH[2],[3] | |||
| H226 et P210 |
|||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 7060 mg/kg (rat, oral)[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
L'orthoformiate d'éthyle est l'orthoester triéthylique de l'acide formique. Il est facilement disponible commercialement mais il peut être aussi préparé par réaction entre du chloroforme (CHCl3) et l'éthanolate de sodium (NaC2H5O)[4]:
- CHCl3 + 3 Na + 3 EtOH → HC(OEt)3 + 3/2 H2 + 3 NaCl
L'orthoformiate d'éthyle sert, en chimie, de solvant et/ou de réactif comme dans la synthèse d'aldéhyde de Bodroux-Chichibabin[5] :
En chimie de coordination, l'orthoformiate d'éthyle est utilisé pour substituer l'eau des complexes métalliques aqueux par des molécules d'éthanol[6] :
- [Ni(H2O)6](BF4)2 + 6 HC(OC2H5)3 → [Ni(C2H5OH)6](BF4)2 + 6 HC(O)(OC2H5) + 6 HOC2H5
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Triethyl orthoformate » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Triethyl orthoformate anhydrous, 98%, consultée le 15/09/2016.
- Entrée « Triethyl orthoformate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 02/02/16 (JavaScript nécessaire).
- ↑ W. E. Kaufmann and E. E. Dreger, Ethyl orthoformate, Org. Synth., coll. « vol. 1 », , p. 258
- ↑ G. Bryant Bachman, n-Hexaldehyde, Org. Synth., coll. « vol. 2 », , p. 323
- ↑ Willem L. Driessen, Jan Reedijk, Solid Solvates: The Use of Weak Ligands in Coordination Chemistry, Inorg. Synth., 1992, vol. 29, pp. 111–118. DOI 10.1002/9780470132609.ch27.