Composé aliphatique
Les composés aliphatiques (du grec aleiphat-, aleiphar, -atos : huile, graisse) sont les hydrocarbures à chaîne ouverte (linéaire ou ramifiée), et ceux comprenant un ou plusieurs cycles non-aromatiques (composés alicycliques)[1]. Les composés aliphatiques peuvent être saturés, comme les paraffines et les alcanes, ou insaturés, comme les alcènes et les alcynes.
Ils sont dits non-aromatiques, par opposition aux composés aromatiques, car ne vérifiant pas les règles d'aromaticité de Hückel — c'est-à-dire ne sont pas aromatiques.
À titre d'exemple, le white spirit contient 80 % d'hydrocarbures aliphatiques et 20 % d'hydrocarbures aromatiques[2].
Remarque : ce terme était à l'origine utilisé pour décrire les acides gras linéaires, notamment des acides aminés comme la glycine (G), l'alanine (A), la valine (V), la leucine (L), l'isoleucine (I) et la méthionine (M). Le seul acide aminé aliphatique cyclique d'importance est la proline (P).
Sous-catégorisation
On peut classer les composés aliphatiques selon leur état physique à température et pression ambiantes[2] :
- gaz : molécules contenant de 1 à 4 carbones (C1 à C4) : méthane, éthane, propane, butane ;
- liquide volatil : molécules contenant de 5 à 8 carbones (C5 à C8) : pentane, hexane, heptane, octane ;
- liquide peu volatil : molécules contenant de 9 à 16 carbones (C9 à C16) ;
- solide : supérieur à C16.
Au sein des composés aliphatiques, on peut distinguer[2] :
- les hydrocarbures saturés (alcanes, de formule chimique générale CnH2n+2 avec n = 1, 2…) ;
- les hydrocarbures insaturés, au sein desquels existent deux groupes :
- les alcènes (formule chimique : R–CH=CH–R', caractérisés par au moins une double liaison ; si la molécule comprend deux doubles liaisons, on parle de -diène (ex. : 1,3-butadiène) ; les alcènes les plus connus sont l'éthylène (C2), le propylène (C3) et le butylène (C4),
- les alcynes (formule chimique : R–C≡C–R'), à triple liaison. Ex. : acétylène (C2).
- Note : les alcanes sont moins toxiques (car moins réactifs) que les alcènes ou les alcynes qui ont des liaisons insaturées les rendant réactifs, y compris vis-à-vis d’eux-mêmes (ils se comportent alors comme des monomères ; propriété utilisée pour produire des polymères tels que le polyéthylène) ou vis à vis, ce qui est plus problématique pour le toxicologue, des molécules biologiques (ex. : le 1,3-Butadiène, issu des combustions d'hydrocarbures, est pour ces raisons cancérogène)[2].
on peut aussi distinguer :
- les aliphatiques à chaîne linéaire :
ex. : le n-hexane est le composé linéaire à six atomes de carbone (hexa- signifiant six) ; - les aliphatiques à chaîne ramifiée :
ex. : le méthylpentane est le composé ramifié à six atomes de carbone.
Des chiffres désignent le numéro de l’atome de carbone où se fait la « ramification ». Ainsi le 3-Méthylpentane a un radical méthyle (CH3) placé sur le troisième atome de carbone et le 2-Méthylpentane a un radical méthyle sur le second atome. Le 4-Méthylpentane n’existe pas ; il est identique au 2-Méthylpentane[2].
Propriétés
La plupart des composés aliphatiques sont de bons solvants et ils sont — plus ou moins facilement — inflammables (ce pourquoi ils sont utilisés comme carburants (du fioul au méthane en passant par le GPL ou l'acétylène utilisé par les soudeurs), après désoufrage pour retirer leur caractère acidifiant et corrosif).
Certains de leurs dérivés (ex. : hydrocarbures aliphatiques halogénés, solvants chlorés aliphatiques) peuvent être toxiques, écotoxiques, cancérigènes, mutagènes, ou sources de produits secondaires toxiques et écotoxiques quand ils brûlent (dioxines, furanes…) et chez certaines espèces neurotoxiques (ex. : chez des coquillages filtreurs comme la palourde[3]).
Exemples
Exemples de composés aliphatiques de faible poids moléculaire :
| Formule brute | Nom UICPA | Représentation | Classification chimique |
|---|---|---|---|
| CH4 | Méthane | 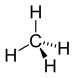 |
Alcane |
| C2H2 | Éthyne | Alcyne | |
| C2H4 | Éthène | 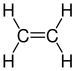 |
Alcène |
| C2H6 | Éthane |  |
Alcane |
| C3H4 | Propyne | Alcyne | |
| C3H6 | Propène | 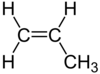 |
Alcène |
| C3H8 | Propane |  Crédit image:
licence CC BY-SA 3.0 🛈 |
Alcane |
| C4H6 | 1,2-Butadiène |  |
Diène |
| C4H6 | But-1-yne |  |
Alcyne |
| C4H8 | But-1-ène | Alcène | |
| C4H10 | Butane | 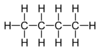 |
Alcane |
| C4H10 | 2-Méthylpropane |  |
Alcane |
| C6H10 | Cyclohexène | Cycloalcène | |
| C5H12 | n-Pentane | Alcane | |
| C7H14 | Cycloheptane | Cycloalcane | |
| C7H14 | Méthylcyclohexane | 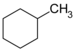 |
Cyclohexane |
| C8H8 | Cubane |  |
Cyclobutane |
| C9H20 | Nonane | Alcane | |
| C10H12 | Dicyclopentadiène |  |
Diène, Cycloalcène |
| C10H16 | Phellandrène | 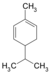  |
Terpène, Diène, Cycloalcène |
| C10H16 | α-Terpinène | Terpène, Diène, Cycloalcène | |
| C10H16 | Limonène |  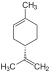 |
Terpène, Diène, Cycloalcène |
| C11H24 | Undécane | Alcane | |
| C30H50 | Squalène | Terpène, Polyène | |
| C2nH4n | Polyéthylène | Alcane |
Autres exemples :
Dérivés
Les hydrocarbures alicycliques sont des composés cycliques dérivés de la série aliphatique, avec par exemple[2] :
- les cycloalcanes (ex. : cyclohexane) ;
- les cycloalcènes (contenant une double liaison) ;
- les cycloalcadiènes (à deux doubles liaisons) ;
- les terpènes (très présents dans le monde végétal).
Références
- (en) G. P. Moss, P. A. S. Smith et D. Tavernier, Glossary of class names of organic compounds and reactive intermediates based on structure (IUPAC Recommendations 1995) [PDF], Aliphatic compounds, p. 7, Pure and Applied Chemistry, vol. 67, p. 1307-1375.
- Cicolella, A. (2008), Les composés organiques volatils (COV) : définition, classification et propriétés, Revue des Maladies Respiratoires, vol. 25, no 2, p. 155-163, DOI 10.1016/S0761-8425(08)71513-4.
- Spencer P.S., Kim M.S. et Sabri M.I. (2002), Aromatic as well as aliphatic hydrocarbon solvent axonopathy, International Journal of Hygiene and Environmental Health, 205, 131-136.
