Mutation génétique

Une mutation génétique est une modification rare, accidentelle ou provoquée, de l'information génétique (séquence d’ADN ou d’ARN) dans le génome.
Selon la partie du génome touchée, les conséquences d'une mutation peuvent varier. Une mutation est dite héréditaire si la séquence génétique mutée est transmise à la génération suivante (voir mutations germinales). Elle est l’un des éléments de la biodiversité et l’un des nombreux facteurs pouvant éventuellement participer dans l'évolution de l'espèce.
Types de mutation
On peut distinguer plusieurs types de mutations.[réf. nécessaire]
Une mutation est dite sexuelle lorsqu'elle concerne un chromosome sexuel, par exemple X/Y chez les mammifères ou W/Z chez les oiseaux. Une mutation est dite autosomique lorsqu'elle touche un autre chromosome que les chromosomes sexuels.
Mutations ponctuelles

Une mutation est dite ponctuelle dès lors qu'elle touche un ou plusieurs nucléotides d'un même gène.
Mutations par substitution
- Mutations faux sens : Cette mutation ponctuelle se traduit par le remplacement d'un nucléotide par un autre. Dans certains cas, cette modification entraîne une modification de l'acide aminé codé, laquelle peut avoir ou non une répercussion sur la fonction de la protéine produite par le gène, dans le cas d'un gène codant, ou sur l'affinité pour un facteur de transcription, dans le cas d'une zone promotrice de l'ADN. On parle de mutation de transition lorsqu’il y a substitution d’une base purique à une autre base purique (ou d’une base pyrimidique à une autre base pyrimidique). Au contraire, une mutation de transversion est une mutation causée par le remplacement d’une base purique par une base pyrimidique (ou d’une base pyrimidique par une base purique).
- Mutations non-sens : Le changement d'un nucléotide provoque le remplacement d'un codon spécifiant un acide aminé par un codon-stop. Cela entraîne la production d'une protéine tronquée.
- Mutations silencieuses : Ce sont des mutations qui ne modifient pas la séquence d'une protéine, à cause de la redondance du code génétique (le nouveau triplet code le même acide aminé que le triplet original), ou parce qu'elle touche une région non codante de l'ADN, ou un intron. Mais cette mutation peut néanmoins avoir de graves conséquences sur le phénotype. En effet, le changement d'un seul nucléotide peut changer le site donneur d'épissage, sans pour autant changer la séquence en acides aminés. Cela peut donc se traduire par une délétion entière d'un exon de la séquence peptidique, l'exon n'étant pas reconnu car le site d'épissage a été muté. Une mutation synonyme désigne une mutation silencieuse qui touche un exon, sans changer la séquence de la protéine.
Insertions et délétions
Les insertions et les délétions sont des mutations décalantes, et sont les deux types de mutations dites indel ou frame-shift. Une addition ou une suppression de nucléotides non multiple de 3 provoquera un changement de cadre de lecture du code génétique. Au moment de la traduction, cela générera le plus souvent une protéine tronquée par l'apparition d'un codon-stop prématuré.
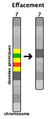
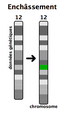
Mutations chromosomiques


Cela concerne un grand nombre de nucléotides dans l'ADN de telle sorte que la mutation est observable lorsqu'on fait un caryotype : duplication, translocation, inversion, délétion, insertion.
Il peut s'agir aussi d'une perte ou d'un gain de chromosomes : trisomie, monosomie, aneuploïdie.
-
 Crédit image:licence CC BY-SA 3.0 🛈
Crédit image:licence CC BY-SA 3.0 🛈 -
 Crédit image:licence CC BY-SA 3.0 🛈
Crédit image:licence CC BY-SA 3.0 🛈 -
 Crédit image:licence CC BY-SA 3.0 🛈
Crédit image:licence CC BY-SA 3.0 🛈
Mutations dynamiques
Ces mutations évoluent d'une génération à l'autre, elles correspondent à des répétitions importantes de certains triplets au niveau de l'ADN (CAG et GGG). Elles sont rencontrées dans certaines maladies génétiques (Syndrome de l'X fragile, dystrophie myotonique de Steinert, maladie de Huntington, ataxie de Friedreich).
Mutations somatiques ou germinales
- On parle de mutation germinale ou mutation de novo, quand la mutation porte sur l'ADN des cellules souches d'un gamète. Dans ce cas, l'embryon sera porteur de la mutation alors qu'aucun de ses parents ne la possédait dans son patrimoine génétique. Ce type de mutation survient lors de la formation ou de la vie des gamètes d'un des deux parents (ovule ou spermatozoïde).
Dans ce cas, il semblerait que les mutations apportées par le spermatozoïde prédominent ; selon une étude, environ 80 % des aberrations chromosomiques des chromosomes des descendants proviendraient du matériel chromosomique apporté par le spermatozoïde et la proportion de spermatozoïdes anormaux serait corrélée à l'âge du parent mâle[2]. Toutefois, les anomalies apportées par la mère restent fréquentes et tendent également à augmenter avec l'âge. - Les mutations somatiques ne touchent pas les cellules destinées à la reproduction, elles ne sont donc jamais héréditaires :
- les mutations post-zygotiques sont les mutations qui apparaissent dans l'œuf après sa fécondation. Elles sont plus rares et s'expriment sous forme de mosaïque chez l'individu concerné,
- des mutations peuvent apparaître tout au long de la vie sur l'ADN de n'importe quelle cellule ; elles sont alors transmises à la lignée des cellules filles. Ces dernières peuvent, dans certains cas, devenir des cellules tumorales puis former un cancer.
Chez les animaux pluricellulaires, les mutations de la lignée germinale peuvent être transmises à la descendance, contrairement aux mutations somatiques.
Origines ou causes de mutations
Les mutations naturelles sont aléatoires, mais leur fréquence d'apparition peut être augmentée par des mutagènes, parfois qualifiés d’agents ou de facteurs mutagènes. Ces agents peuvent être physiques (rayonnements ionisants) ou chimiques (agents alkylants, dérivés réactifs de l'oxygène...).
Des procédés permettent aujourd'hui de provoquer des mutations non aléatoires et contrôlées (Type et Nature de la mutation). Ces procédés sont notamment fortement utilisés dans l'étude du vivant, par exemple pour comprendre les fonctions d'un gène.
Différents niveaux des mutations
La mutation se définit traditionnellement comme une modification de l’information génétique, décelable par un changement brusque et d’emblée héréditaire intervenant au niveau d’un ou plusieurs caractères[3].
Cependant, la mise en évidence de l’ADN comme support chimique de l’information génétique et la possibilité d’accéder à la connaissance précise de la séquence des nucléotides qui caractérise chaque chromosome a conduit à proposer une nouvelle définition : tout changement affectant la séquence des nucléotides est une mutation[3].
Mutations et génétique des populations
De plus, au niveau de la génétique des populations la mutation se définit comme une erreur dans la reproduction conforme du message héréditaire. Elle va transformer un allèle en un autre, nouveau ou déjà présent dans la population. Le rôle de la mutation dans l’évolution est primordial, car c’est la seule source de gènes nouveaux. Mais une fois qu’un nouveau gène est apparu par mutation, ce n’est pas plus elle qui va déterminer son devenir : si le nouvel allèle est défavorable, ou s’il est plus favorable que les anciens, c’est principalement la sélection qui va déterminer l’évolution ultérieure de sa fréquence[4].
Au niveau des populations, la croissance n'est pas un problème pour la mutation, elle aide les populations, bien au contraire... La persistance dépend en général du maintien de l’information génétique. Pour ce faire, les organismes essayent de réduire le taux de mutation et limiter les mutations délétères. Cependant, l'adaptation à de nouvelles situations nécessite un certain niveau de variation génétique pour fournir de rares mutations bénéfiques. Le nombre de mutations générées dans une population est déterminé par la taille de celle-ci ainsi que le taux de mutation des organismes qui la composent. Par conséquent, pour toute taille de population viable donnée, un organisme devrait développer un taux de mutation qui optimise l'équilibre entre les mutations délétères communes et des mutations plus rares qui augmentent la fitness (chances de survie) à long terme. Le rapport optimal des coûts aux bénéfices devrait changer avec les circonstances et les habitudes de vie. Un taux de mutation élevé pourrait être plus coûteux pour un organisme bien adapté dans un environnement constant que pour un organisme mal adapté dans un environnement très variable[5].
Toutefois, les taux de mutations sont contrôlés et minimisés par la sélection. Des arguments théoriques et expérimentaux montrent que des mutateurs peuvent être sélectionnés positivement lors de la croissance dans certains milieux - lorsque la sélection nécessite des mutations rares répétées et que la variabilité disponible est limitée. Cela se produit lorsque la population est petite et que les mutants rares peuvent offrir un avantage sélectif (par exemple la résistance aux antibiotiques) plus important que le coût sélectif pour la fitness.
Par exemple dans le cas du virus HIV-1 de nombreuses mutations aléatoires surviennent à chaque cycle de réplication virale du fait de la faible fidélité de la transcriptase inverse lors de la transcription. Certaines de ces mutations seront sélectionnées par la pression qu’exercent les CTL (Lymphocytes T Cytotoxiques) spécifiques des épitopes sauvages. Or les réponses cytotoxiques précoces semblent avoir une activité antivirale plus efficace, et l’échappement à cette réponse expliquerait la progression virale[6],[7].
Une partie des maladies (maladies génétiques) ou certains avortements sont liés à des mutations délétères ou mortelles du patrimoine génétique. Le taux de mutation de l'espèce humaine est mal connu. Des mutations naturelles et/ou dues à l'exposition à des produits mutagènes d'origine anthropique concernent aussi l'espèce humaine ; L'exposition à certains produits radioactifs (contexte d'essais nucléaires, d'accidents) et à divers produits chimiques mutagènes pourrait avoir augmenté le taux de mutation au sein de l'espèce. Il a fait l'objet de quelques évaluations, dont récemment par la mesure de l'autozygotie d'une population d'Huttériens généalogiquement bien connue afin d'estimer, au sein de cette population, le taux de mutation de séquences génétiques humaines sur plusieurs générations[8]. Le séquençage de génomes entiers de 5 trios constitués chacun de deux parents et d'un enfant a permis d'identifier 44 segments concernés par l'autozygosité. Sur cette base et à partir du polymorphisme nucléotidique les chercheurs ont obtenu un taux de mutation « SNV (single-nucleotide variants) » de 1,20 × 10-8 mutations par paire de base et par génération. Le taux de mutation pour les bases au sein des dinucléotide CpG (9,72 × 10-8) était de 9,5 fois supérieur à celui des bases non CpG, et ces mutations sont à 85 % d'origine paternelle. La distribution non uniforme des mutations évoque des « points chauds mutationnels » ou l'existence d'autres sites de conversion génique à long terme[8].
Types de mutations dans le HIV-1
Plusieurs types de mutations peuvent perturber la présentation des molécules du CMHI. Des mutations au niveau des régions flanquantes des épi-topes vont interférer avec la capacité de clivage des protéines virales par le protéasome ou avec la capacité de transport intracellulaire. De la même façon, des mutations survenant dans les épi-topes eux-mêmes diminuent la réponse cytotoxique spécifique par les CTL. Si ces mutations concernent les résidus d’ancrage, elles sont susceptibles d’entraîner une inhibition complète de la liaison du peptide avec les molécules du CMHI.
Enfin, les mutations touchant les acides aminés encadrant les résidus d’ancrage dans les épi-topes peuvent également modifier l’interaction du peptide avec la molécule du CMHI pour des raisons conformationnelles. Si la liaison CMHI-peptide n’est pas stable, le complexe est dissocié avant la rencontre avec le TCR (T cell receptor) et la reconnaissance du peptide viral par le CTL ne peut pas avoir lieu.
Le VIH est soumis à trois types de pression : structurale, fonctionnelle et de sélection exercée par la réponse immune spécifique dans les régions immunogènes. Ainsi, le virus est contraint en permanence à un équilibre entre les mutations des épi-topes, qui permettent l’échappement à la reconnaissance par cette réponse immune spécifique, mais ces mutations pourrait induire un coût fonctionnel pour le virus comme une diminution de sa capacité de réplication ou de son pouvoir infectant. En outre, dans le cas de la réponse CTL, il a été montré que des mutations survenant dans les régions fonctionnellement importantes conduiraient à la non-viabilité des mutants. Par exemple des mutations d’échappement dans la région codant Gag p-24 vont produire une diminution significative de la fitness, par contre les mutations dans les régions Env gp 120 n’ont pas d’effet pour la fitness virale[9],[10].
Transmission des mutations
Si une mutation affecte une cellule germinale participant à une fécondation, elle est transmise à l'individu issu de cette fécondation, et sera présente dans chacune de ses cellules. Cette mutation peut procurer un avantage sélectif ou au contraire être délétère, voire létale. C'est la base du processus de l'évolution. Il est cependant admis que la plupart des mutations interviennent entre les gènes, dans les introns, ou à des endroits où leur effet est minime (mutations synonymes) ; la plupart des mutations sont donc probablement neutres, et ne sont conservées (ou éliminées) que par hasard (dérive génétique).
En revanche, comme c'est le cas pour la plupart des mutations accidentelles (provoquées par irradiation ou substances chimiques), si elle affecte les cellules somatiques, la mutation ne se transmet pas et n'affectera donc que le sujet l'ayant subie directement. Si les cellules se divisent activement, il y a possibilité de création d'une tumeur pouvant évoluer en cancer. À l'opposé, s'il n'y a pas de division l'effet est négligeable.
Conséquences des mutations

Les mutations peuvent être classées selon leurs conséquences phénotypiques :
- les mutations peuvent avoir de plus ou moins importantes conséquences phénotypiques (certaines d'entre elles peuvent avoir des conséquences graves, conduisant à des maladies génétiques, ou dans prédispositions à des maladies génétiques, par exemple dans certains cancers, car la modification d'un seul acide aminé dans la chaîne constituant une protéine peut modifier complètement sa structure spatiale, qui conditionne son fonctionnement) ; elles peuvent modifier le plan d'organisation et l'anatomie de l'organisme comme pour les mutations homéotiques ;
- les mutations conditionnelles ou variants génétiques cryptiques, ne s'expriment que dans certaines conditions particulières (élévation de la température, niveau d'hydratation, etc.) ;
- les mutations silencieuses n'ont aucun effet sur l'organisme, car elles n'entraînent aucun changement dans la séquence d'acides aminés de la protéine codée, ce qui est dû aux nombreuses redondances dans le code génétique. En effet, la troisième base d'un codon n'est en général pas codante (de fait, plusieurs codons différents codent le même acide aminé) par contre, un problème pour la croissance humaine pourrait donc se créer. Cette propriété est appelée redondance (ou dégénérescence) du codage ;
- les mutations neutres ne modifient pas la capacité à se reproduire, et n'ont donc aucun effet sur la sélection naturelle. C'est le cas des mutations qui ont abouti à l'apparition des caractères neutres, comme les groupes sanguins, qui n'ont a priori aucune incidence sur la capacité à se reproduire.
Conséquences dans l'évolution biologique
Les mutations expliquent l'existence d'une variabilité entre les gènes. Les mutations qui sont le moins favorables (délétères) à la survie de l'individu qui les porte, sont éliminées par le jeu de la sélection naturelle, alors que les mutations avantageuses, beaucoup plus rares, tendent à s'accumuler. La plupart des mutations sont dites neutres, elles n'influencent pas la valeur sélective et peuvent se fixer ou disparaître par le jeu de la dérive génétique. Les mutations spontanées, généralement rares et aléatoires, constituent donc la principale source de diversité génétique, moteurs de l'évolution. Les causes des mutations spontanées sont inconnues.
Les mutations brutales engendrées par le césium 137 (137Cs), lors de l’accident de Tchernobyl par exemple, n’ont aucun effet bénéfique et durable sur le génome d’une espèce, ici l’homme. Mais les effets du 137Cs ne sont remarquables que sur la descendance du sujet contaminé (malformations cardiaques, troubles de la minéralisation osseuse, troubles cérébraux) pour une exposition à forte dose[réf. nécessaire].
Détection des mutations
Les différentes techniques de détection de mutation sont :
- polymorphisme de longueur des fragments de restriction (RFLP) ;
- polymorphisme de conformation des simples brins (SSCP) ;
- électrophorèse sur gel en gradient dénaturant (DGGE) ;
- réaction en chaîne par polymérase (PCR) et séquençage de Sanger ;
- analyse des courbes de fusion à haute résolution (HRM) ;
- séquençage haut débit (NGS).
Éléments historiques
Le terme de mutation est introduit en 1869[11] dans le sens paléontologique (légères variations de formes dans les coquilles d'Ammonites) par le géologue allemand Waagen. Le botaniste néerlandais Hugo de Vries est le premier à l'employer dans son sens génétique dans le cadre de sa théorie mutationniste[12] élaborée de 1901 à 1903[13].
Le terme scientifique est chargé de connotations négatives, surtout depuis son association dans la presse des années 1950, à l'action mutagène des radiations ionisantes (effet découvert en 1926 par Muller) provenant d'incidents ou accidents nucléaires et des essais nucléaires menés au plus fort de la guerre froide. L'augmentation ultérieure des connotations négatives semble provenir de sources plus diffuses[14],[15].
Notes et références
- LLNL d'après X. Lowe, et al., "Aneuploidies and Micronuclei in the Germ Cells of Male Mice of Advanced Age", Mutation Research ; 1995) D'après X. Lowe, et al., "Aneuploidies and Micronuclei in the Germ Cells of Male Mice of Advanced Age", Mutation Research ; 1995.
- The Genetic Contribution of Sperm:Healthy Baby or Not? ; Science & Technology Review November/December 1995, LLNL, USA.
- Jean-Luc Rossignol et al. 2004. Génétique Gènes et Génomes. Dunod. France. 232p.
- Jean-Pierre Henry et Pierre-Henry Gouyon, Précis de génétique des populations, Dunod, France, 2008, 186 p.
- De visser Ja, Rozen De. Limits to Adaptation in asexual populations, J. Évol. Biol. 18: 779-88, 2005.
- Rainey PB. 1999, Evolutionary Genetics: The Economics of Mutation.Curr Biol 9: 371-3.
- Sniegowski et al. 2000, The Evolution of mutation rates: separating causes from consequences, BioEssays 22: 1057-66.
- Catarina D Campbell & al., the human mutation rate using autozygosity in a founder population ; Nature Genetics (Letter), 2012-09-23, doi:10.1038/ng.2418.
- Troyer et al.2009. Variable Fitness Impact of HIV-1 Escape Mutations to Cytotoxic T lymphocyte (CTL) Response. Plos Pathogens 5(4): e1000365. doi:10.1371/journal.ppat.1000365
- Stankovic et al.2004. Échappement moléculaire à la réponse immune T cytotoxique : le cas des protéines non structurales du virus de l’immunodéficience humaine et simienne. Virologie 2:143-51.
- (de) W. Waagen, « Die Formenreihe des Ammonites subradiatus », Benecke's Paleont. Beitrage, vol. 11, , p. 179–257.
- H. de Vries, Die mutationstheorie, Veit & Co., 1901-1903, Leipzig ; 2 volumes, 1 : 648 p ; 2 : 753 p.
- (en) David Neil Cooper, Michael Krawczak, Human Gene Mutation, Bios Scientific publishers, , p. 4
- (en) Celeste M Condit, Paul J Achter, Ilon Lauer, Enid Sefcovic, « The changing meanings of "mutation:" A contextualized study of public discourse », Human Mutation, vol. 19, no 1, , p. 69-75 (DOI 10.1002/humu.10023).
- (en) Anders Hansen, Mass Communication Research Methods, SAGE, , p. 190.
Voir aussi
Articles connexes
- Horloge moléculaire
- Mutation neutre
- Mutation silencieuse
- Mutation récessive
- Mutation dans la fiction
- Mutagenèse
- Mutabilité catastrophique
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Moroccan Human Mutation Database
- (fr) Cours de génétique sur le site de l'université Paris-Sud 11



