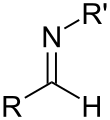
Imine


Une imine est un composé organique caractérisé par une double liaison carbone-azote. De plus, l'azote est lié grâce à son troisième électron de valence à un second groupe alkyle ou à un hydrogène.
Nomenclature et classification
Les imines sont des analogues aux composé carbonylés (aldéhydes et cétones), où l'oxygène est remplacé par un groupe NR. Lorsque R = H, le composé est une imine primaire, et lorsqu'il s'agit d'un hydrocarbyle (alkyle, aryle, etc.), c'est une imine secondaire. Les imines secondaires sont aussi appelées bases de Schiff (au sens large). Lorsque R est un groupe hydroxyle (OH), on appelle cette imine oxime, et lorsqu'il s'agit d'un groupe NH2 on parle d'hydrazone.
Aldimines et cétimines
Une imine dans laquelle le carbone lié à l'azote n'est attaché qu'à un groupe alkyle et à un atome d'hydrogène est appelée « aldimine » (de aldéhyde et imine). En fonction du fait que l'atome d'azote soit lié à un atome d'hydrogène ou un groupe hydrocarbyle, on l'appellera « aldimine primaire » ou « aldimine secondaire »[1].
Une imine dans laquelle le carbone lié à l'azote est attaché deux groupes alkyles est appelée « cétimine » (de cétone et imine). De même, en fonction de la nature du substituant de N, on l'appellera « cétimine primaire » ou « cétimine secondaire »[2].
-
Aldimine primaire
-
Aldimine secondaire
-
Cétimine primaire
-
Cétimine secondaire
Synthèse
Les imines sont formées par condensation d'un composé carbonylé (aldéhyde ou cétone) et une amine primaire (ou l'ammoniac NH3). Il se forme une molécule d'eau lors de cette réaction. Selon le carbonyle utilisé, la réaction est plus ou moins déplacée dans le sens de formation de l'imine.
Comme exemple de cette classe de produit, il y a l'éthanimine qui possède deux atomes de carbone, 5 atomes d'hydrogène, un atome d'azote et une double liaison relie l'atome d'azote à un des atomes de carbone. Sa formule semi-développée est CH3-CH=NH.
Mécanisme
La méthode classique de formation d'une imine est de faire réagir un composé carbonylé (aldéhyde ou cétone) sur une amine primaire, en présence d'un acide, l'électrophilie de l'atome de carbone du groupe carbonyle est ainsi augmentée par protonation. La réaction est favorisée par l'élimination de l'eau du milieu au fur et à mesure de sa formation.

Notes et références
- ↑ (en) « aldimines », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- ↑ (en) « ketimines », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
Annexes
Bibliographie
- (en) Kurt Peter C Vollhardt et Neil Eric Schore, Organic chemistry : structure and function, New York, W.H. Freeman, , 5e éd., 1254 p. (ISBN 978-0-7167-7235-4 et 978-0-716-79949-8).