Haplogroupe R1b
En génétique humaine, l'haplogroupe R1b (R-M343) est un haplogroupe du chromosome Y.
Cet haplogroupe se compose de trois principaux sous-clades, R1b-M269, très fréquent en Europe de l'Ouest, R1b-V88 qui se retrouve surtout dans certaines parties de l'Afrique subsaharienne et au Moyen-Orient et R1b-M73 qui se rencontre en Asie du Sud et de l'Ouest. Ces sous-groupes partagent un ancêtre paternel commun qui aurait vécu il y a environ 15 000 ans.
R1b est l'un des principaux haplogroupes du chromosome Y en Europe après la transition néolithique tardif / âge du bronze ; il s'est répandu en Europe au cours de la seconde moitié du troisième millénaire avant notre ère et est originellement lié à l'ascendance de la steppe eurasienne.
R1b-M269 se retrouve le plus communément le long du littoral atlantique de l'Europe, et par les émigrations européennes, en Amérique du Nord, en Amérique du Sud et en Australie. En Angleterre, la fréquence du R1b-M269 est d'environ 70 %, et dans certaines parties du nord et de l'ouest de l'Angleterre, de l'Espagne, du Portugal, de la France, de la Bretagne, du Pays de Galles, de l'Écosse et de l'Irlande, la fréquence de R1b est plus élevée que 90 %. On le trouve aussi chez les Italiens, particulièrement dans le Nord de l'Italie. R1b-M269 est aussi présent à des fréquences moindres à travers l'Europe de l'Est, bien que la diversité y soit plus forte qu'en Europe de l'Ouest. On suggère une ancienne migration de R1b venant de l'Est.
R1b-V88, se retrouve surtout dans certaines régions de l'Afrique subsaharienne (centre du Sahel, nord du Cameroun, nord du Nigeria, Tchad et Niger). Sa fréquence atteint 95 % au nord du Cameroun. On le trouve également dans une moindre mesure en Afrique du nord notamment chez les Berbères égyptiens de l'oasis de Siwa (27 %)[1].
La fréquence la plus élevée de R1-M73 a été trouvée dans la République de Bachkirie (55 %).

Origine
L'âge de R1 a été estimé par Tatiana Karafet et al. (2008) entre 25 700 et 12 500 ans avant présent (AP), et son apparition s'est probablement produite il y a environ 18 500 ans. Comme le plus ancien vestige connu est âgé d'environ 14 000 ans et est identifié en R1b1a (R-L754), R1b doit être apparu relativement tôt après l'émergence de R1.
Alors que la prédominance de R1b en Europe occidentale aujourd'hui doit son origine aux migrations de l'âge du bronze depuis la steppe d'Europe orientale, sa présence à Villabruna et chez un agriculteur ibérique âgé d'environ 7 000 ans documentent une histoire plus profonde de cet haplotype dans des régions plus occidentales de l'Europe. Une preuve supplémentaire d'un lien précoce entre l'ouest et l'est provient du locus HERC2, où un allèle dérivé qui est le principal moteur de la couleur des yeux clairs chez les Européens apparaît presque simultanément chez des spécimens d'Italie il y a environ 14 000 à 13 000 ans[2].
Les restes humains les plus anciens porteurs de R1b se retrouvent dans les sites ou individus suivants :
- Villabruna 1 : individu I9030, un chasseur-cueilleur (WHG) trouvé dans un site de la culture épigravettienne dans la vallée de Cismon (Vénétie moderne, Italie), a vécu il y a environ 14 000 ans et classé R1b-L754[2].
- Aven des Iboussières à Malataverne (26) un individu a vécu il y a environ 12090 à 11460 ans, lui aussi R1b-L754 (cf site indo european.eu et antrogenica)
- de nombreux individus appartenant à la culture des Portes de fer mésolithiques du Danube central (Roumanie et Serbie actuelles), datant de 10 000 à 8 500 ans ; la plupart d'entre eux classés en groupe R1b-L754
- deux individus, âgés d'environ 7 800 à 6 800 ans, trouvés sur le site de sépulture de Zvejnieki, appartenant à la culture de Narva du néolithique balte, tous deux classés à la sous-classe R1b-P297
- le « chasseur-cueilleur de Samara » (I0124/SVP44), qui vivait environ 7 500 ans dans la région de la Volga classé R1b-L278. Selon une étude de 2015, ce chasseur-cueilleur de Samara appartenant à l'haplogroupe R1b1(*) était ancestral pour les deux haplogroupes R-M269 et R-M478. Selon les auteurs, la présence de formes basales de R1b chez les chasseurs-cueilleurs d'Europe de l'Est fournit une « source géographiquement plausible » pour l'haplogroupe R-M269[3].
Dispersion en Europe
En dehors de la Russie et avant le néolithique tardif, seuls quelques individus R1b ont été trouvés en Europe[2]. Ceci contraste avec la constatation que les haplogroupes R1a et R1b ont été trouvés dans 60 % des Européens du néolithique tardif / de l'âge du bronze en dehors de la Russie et dans 100 % des échantillons de la Russie européenne de toutes les périodes (7500-2700 avant notre ère). R1a et R1b sont les haplogroupes les plus courants dans de nombreuses populations européennes aujourd'hui. Ces résultats suggèrent qu'ils se sont répandus en Europe depuis l'Est après 3 000 ans avant notre ère[3].
Les études de paléogénétiques ont identifié le sous clade M269 au sein de R1b qui est prédominant chez les Européens aujourd'hui chez des individus de la culture Yamna, dont les exemplaires étudiés appartenaient tous à ce sous-clade[3].
Le plus ancien squelette de l'haplogroupe R1b détecté en Europe occidentale appartient à la culture campaniforme[3]. L'identification de cet haplogroupe vers 2 500 ans avant notre ère dans le nord de la France confirme sa présence sur le territoire français dès cette période. Les individus associés à la culture campaniforme en France présentent un large éventail de proportions d'ascendance steppique[4].
Distribution
Répartition des principaux sous-clades R1b-M269, R1b-V88 et R1b-M73[1]:
| Continent | Population | N | Total | R1b-V88 | R1b-M269 | R1b-M73 |
|---|---|---|---|---|---|---|
| Afrique | Région du Sahel central | 461 | 23.00% | 23.00% | 0.00% | 0,00 % |
| Afrique | Afrique du nord | 691 | 5.90% | 5.20% | 0.70% | 0,00 % |
| Afrique | Afrique de l'Ouest | 123 | 0.00% | 0.00% | 0.00% | 0,00 % |
| Afrique | Afrique de l'Est | 442 | 0.00% | 0.00% | 0.00% | 0,00 % |
| Afrique | Afrique du Sud | 105 | 0.00% | 0.00% | 0.00% | 0,00 % |
| Asie | Asie | 328 | 5.80% | 0.30% | 5.50% | 0,00 % |
| Asie | Asie du Sud | 288 | 4.80% | 0.00% | 1.70% | 3,10 % |
| Asie | Asie de l'est | 156 | 0.60% | 0.00% | 0.60% | 0,00 % |
| Asie | Asie du Sud-Est | 10 | 0.00% | 0.00% | 0.00% | 0,00 % |
| Asie | Asie du Nord-Est | 30 | 0.00% | 0.00% | 0.00% | 0,00 % |
| Europe | Europe de l'Ouest | 465 | 57.80% | 0.00% | 57.80% | 0,00 % |
| Europe | Europe du Nord-Ouest | 43 | 55.80% | 0.00% | 55.80% | 0,00 % |
| Europe | Europe centrale | 77 | 42.90% | 0.00% | 42.90% | 0,00 % |
| Europe | Europe de l'Est | 149 | 20.80% | 0.00% | 20.80% | 0,00 % |
| Europe | Europe du Sud-Est | 510 | 13.10% | 0.20% | 12.90% | 0,00 % |
| Europe | Russie | 60 | 6.70% | 0.00% | 6.70% | 0,00 % |
| Europe | Europe du Nord-Est | 74 | 1.40% | 0.00% | 1.40% | 0,00 % |
Sous-clades principaux
R1b1a1a1 (R-M73)
La branche R1b-M73 est fréquente dans la steppe eurasienne. Elle a également été trouvée dans des échantillons mésolithiques de Lettonie ainsi que dans de nombreux groupes modernes de Sibérie méridionale et d'Asie centrale[5].
Une étude publiée en 2018 a indentifié le clade R-M73 dans 37,5 % (15/40) d'un échantillon de Téléoutes de Bekovo, oblast de Kemerovo, 4,5 % (3/66) d'un échantillon d'Ouïghours de la région autonome ouïghoure du Xinjiang, 3,4 % (1/29 ) d'un échantillon de Kazakhs du Kazakhstan, 2,3 % (3/129) d'un échantillon de Selkoupes, 2,3 % (1/44) d'un échantillon de Turkmènes du Turkménistan et 0,7 % (1/136) d'un échantillon d'Iraniens d'Iran[6].
R1b1a1a2 (R-M269)
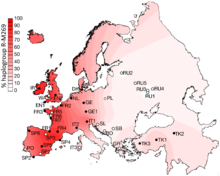
R1b-M269 est l'haplogroupe le plus courant en Europe de l'Ouest et notamment en France. En 2010, il était porté par environ 110 millions d'hommes en Europe[7].
Selon des études génétiques récentes, l'haplogroupe R1b-M269, qui représente 60 % des lignées masculines en France, pourrait être associé aux Indo-Européens arrivés en Europe durant l'Âge du bronze et qui auraient remplacé une grande partie de la population néolithique masculine existante[8],[9]. L'haplogroupe R1b-M269 est déjà présent dans la culture Yamna. Plus précisément, le sous-clade R-L23 (R-Z2103) s’est avéré prédominant dans les anciens ADN associés à la culture Yamna[9]. Selon une étude (2017) du généticien Mattias Jakobsson de l'université d'Uppsala, les migrants yamnayas porteurs de l'haplogroupe auraient été quasi exclusivement mâles, dans une proportion de 10 pour une femme[10],[11], ce qui peut suggérer une migration de guerriers.
Les populations celtiques seraient caractérisées par différents sous-groupes de l'haplogroupe R1b-M269 introduit en Europe par ces migrations indo-européennes[12].
Sous-groupes
Ce sous-clade comprend à ce jour de très nombreux sous-groupes dont les principaux ci-dessous :
- R1b-M269
- R1b-U106
- R1b-P312
- R1b-L21
- R1b-S28/U152
- R1b-DF27
Dans l'arbre Y-chromosome, R1b-U106 et R1b-P312 sont frères. P312 se trouve ultra-majoritaire autour de l'Atlantique, avec des taux dépassant les 80 % en Bretagne et dans le Pays basque. U152, L21 et DF27, sont les trois principaux fils de P312. La branche germanique R1b-U106 (S21), apparue il y a environ 3 000 ans en Europe centrale ou en Frise, se trouve principalement autour de la Mer du Nord, mais à des fréquences moins élevées que les P312 proches de l'Atlantique. En 2018, le plus ancien exemplaire de R1b-U106 étudié provenait d'un site de la culture d'Unétice datant de 2200-1700 av. J.C. à Jinonice en République tchèque[13].
Les 3 « fils » de P312 se sont développés dans des régions différentes de l'Europe de l'Ouest :
- la branche celtique atlantique R1b-L21 dans le Nord-Ouest (apparue il y a environ 4 000 ans en Europe de l'est ou centrale)
- la branche italo-celtique R1b-S28/U152 dans l'est (apparue il y a environ 3 500 ans dans la région des Alpes)
- la branche gasco-ibérique R1b-DF27 (dont la sous-branche basque R1b-M153) dans le Sud-Ouest. DF27 est trouvé à une fréquence qui varie de 30 à 50 % dans la péninsule Ibérique. Au Pays basque, la fréquence atteint 74 %. Ce sous-clade est daté globalement d'environ 4 190 ans. Il s'est étendu dans la péninsule Ibérique principalement entre 3 500 et 3 000 ans, soit à l'Âge du Bronze moyen[14].
Une étude de 2019 montre que ce sont des populations de la culture campaniforme qui ont apporté l'ascendance de la steppe pontique venant d'Allemagne et notamment l'haplogroupe R1b-P312 dans la péninsule Ibérique[15]. Une étude publiée en 2021 portant sur la Bohême montre que tous les individus de la culture campaniforme étudiés appartiennent à l'haplogroupe R1b-P312. La majorité de ces individus font partie du sous-clade R1b-L2 à l'inverse des Campaniformes de Grande Bretagne qui sont à majorité du sous-clade R1b-L21, ce qui signifie que les Campaniformes de Grande-Bretagne et de Bohême ne sont pas descendants les uns des autres mais ont plutôt évolué en parallèle à partir d'une population ancestrale commune. Les chercheurs de cette étude supposent que cette population ancestrale a vécu entre les deux régions peut-être au bord du Rhin avant de migrer à la fois vers l'est et vers l'ouest[16].
L'haplogroupe M269 est généralement très rare en Afrique du Nord. Sa fréquence la plus élevée (10-11 %) a été relevée dans la région d'Oran en Algérie[17]. Une fraction algérienne des Sidi Yahia à Tébessa (Thevest) fut analysée (chromosome Y qui se transmet du père au fils), par "Family Tree DNA", il en résulte que l'ancêtre mâle des Sidi Yahia porte le R1b (Eurasid R1b1a2a1a2 (R-P312/S116)) caractéristique des populations eurasiatiques plus particulièrement des Européens occidentaux.
La phylogénie du R-M269 selon ISOGG 2017:
| M269/PF6517 |
| |||||||||||||||||||||||||||||||||||||||||||||
R1b1a2 (R-V88)
R1b1a2 (PF6279 / V88; auparavant R1b1c) est défini par la présence du marqueur SNP V88, dont la découverte a été annoncée en 2010 par Cruciani et al. Outre les individus du Sud de l'Europe et de l'Asie occidentale, la majorité du R-V88 a été trouvée dans le Sahel, en particulier parmi les populations parlant des langues afro-asiatiques de la branche tchadienne.
Sur la base d'une analyse phylogénétique détaillée, D'Atanasio et al. (2018) ont proposé que R1b-V88 soit originaire d'Europe il y a environ 12 000 ans et ait traversé l'Afrique du Nord entre 8 000 et 7 000 ans, pendant la période du « Sahara vert ». R1b-V1589, la principale sous-clade de R1b-V88, a connu une nouvelle expansion il y a environ 5 500 ans, probablement dans la région du bassin du lac Tchad, d'où certaines lignées ont retraversé le Sahara vers l'Afrique du Nord[18].
Marcus et al. (2020) fournissent des preuves solides pour ce modèle proposé de mouvement transsaharien du Nord au Sud : les premiers haplogroupes basaux R1b-V88 ont été trouvés chez plusieurs chasseurs-cueilleurs d'Europe de l'Est il y a près de 11 000 ans[19]. Parmi les plus vieux individus identifiés R1b-V88, on a un individu Mésolithique d'Ukraine daté entre 7 446 et 7 058 av. J.-C.[20]. L'haplogroupe s'est ensuite apparemment propagé avec l'expansion des agriculteurs néolithiques, qui ont établi l'agriculture en Méditerranée occidentale. Des haplogroupes R1b-V88 ont été identifiés chez des individus néolithiques anciens en Allemagne, en Italie centrale, dans la péninsule Ibérique et, à une fréquence particulièrement élevée, en Sardaigne. Une partie de la branche menant aux haplogroupes africains actuels (V2197) était déjà dérivée chez des individus européens néolithiques d'Espagne et de Sardaigne. La présence d'agriculteurs néolithiques européens en Afrique est également attestée par des échantillons du Maroc datant d'environ 5400 av. J.-C.[21].
Références
- (en) Cruciani et al.; Trombetta, B; Sellitto, D; Massaia, A; Destro-Bisol, G; Watson, E; Beraud Colomb, E; Dugoujon, JM et al. (2010). "Human Y chromosome haplogroup R-V88: a paternal genetic record of early mid Holocene trans-Saharan connections and the spread of Chadic languages". European Journal of Human Genetics 18 (7): 800–7. doi:10.1038/ejhg.2009.231. PMC 2987365. .
- (en) Fu Q, Posth C, Hajdinjak M, Reich D et al., « The genetic history of Ice Age Europe », Nature, (PMID 27135931, PMCID 4943878, DOI 10.1038/nature17993, Bibcode 2016Natur.534..200F, hdl 10211.3/198594), p. 200–5
- (en) W. Haak et al., « Massive migration from the steppes is à source for Indo-European languages in Europe », Nature, (lire en ligne [PDF])
- (en) Samantha Brunel et al., Ancient genomes from present-day France unveil 7,000 years of its demographic history, PNAS, 26 mai 2020, https://doi.org/10.1073/pnas.1918034117
- (en) Choongwon Jeong, Oleg Balanovsky, Elena Lukianova, Johannes Krause et al. The genetic history of admixture across inner Eurasia, Nat Ecol Evol. juin 2019; 3(6):966-976. doi:10.1038/s41559-019-0878-2. Epub 29 avril 2019
- (en) Tatiana M. Karafet, Ludmila P. Osipova, Olga V. Savina, Brian Hallmark et Michael F. Hammer, « Siberian genetic diversity reveals complex origins of the Samoyedic-speaking populations », American Journal of Human Biology, (PMID 30408262, DOI 10.1002/ajhb.23194, S2CID 53238849), e23194
- Balaresque P, Bowden GR, Jobling MA et al., « A predominantly neolithic origin for European paternal lineages », PLOS Biology, (PMID 20087410, PMCID 2799514, DOI 10.1371/journal.pbio.1000285), e1000285
- « L'un des plus importants mouvements migratoires serait celui des proto-Indo-Européens caractérisés par les haplogroupes de l'ADN-Y R1a et R1b provenant des peuples des steppes pontiques et asiatiques utilisant des sépultures recouvertes de tumulus, les kourganes », Jean Chaline (préf. Jean-Louis Beaucarnot), Généalogie et génétique : La saga de l'humanité : migrations, climats et archéologie, Paris, Ellipses, , 471 p. (ISBN 978-2-7298-8871-8), p. 307
- « R1a and R1b are the most common haplogroups in many European populations today, and our results suggest that they spread into Europe from the East after 3,000 BCE. » in Haak et al., 2015, Massive migration from the steppe was a source for Indo-European languages in Europe
- Pierre Grumberg, « Actualités : une curieuse migration de mâles a marqué l'Âge du Bronze », Guerres & Histoire, no 36, , p. 17 (ISSN 2115-967X)
- (en) Amy Goldberg, Torsten Günther, Noah A. Rosenberg, and Mattias Jakobsson, Ancient X chromosomes reveal contrasting sex bias in Neolithic and Bronze Age Eurasian migrations, PNAS, 7 mars 2017
- Jean Chaline (préf. Jean-Louis Beaucarnot), Généalogie et génétique : La saga de l'humanité : migrations, climats et archéologie, Paris, Ellipses, , 471 p. (ISBN 978-2-7298-8871-8), p. 254
- (en) Iñigo Olalde, Selina Brace, David Reich..., The Beaker phenomenon and the genomic transformation of northwest Europe, Nature, volume 555, pages 190–196, 8 mars 2018
- (en) Neus Solé-Morata et al., Analysis of the R1b-DF27 haplogroup shows that a large fraction of Iberian Y-chromosome lineages originated recently in situ, Scientific Reports, volume 7, Article numéro: 7341, 2017
- (en) Iñigo Olalde, Swapan Mallick […], David Reich, The genomic history of the Iberian Peninsula over the past 8000 years, Science 15 Mar 2019: Vol. 363, Issue 6432, pp. 1230-1234
- (en) Luka Papac et al., Dynamic changes in genomic and social structures in third millennium BCE central Europe, Science Advances, Vol. 7, no. 35, 25 août 2021, eabi6941, DOI: 10.1126/sciadv.abi6941
- (en) Robino C, Crobu F, Di Gaetano C, et al. (May 2008). "Analysis of Y-chromosomal SNP haplogroups and STR haplotypes in an Algerian population sample". International Journal of Legal Medicine 122 (3): 251–5. doi:10.1007/s00414-007-0203-5. .
- D'Atanasio E, Trombetta B, Bonito M, Finocchio A, Di Vito G, Seghizzi M, Romano R, Russo G, Paganotti GM, Watson E, Coppa A, Anagnostou P, Dugoujon JM, Moral P, Sellitto D, Novelletto A, Cruciani F, « The peopling of the last Green Sahara revealed by high-coverage resequencing of trans-Saharan patrilineages », Genome Biology, vol. 19, no 1, , p. 20 (PMID 29433568, PMCID 5809971, DOI 10.1186/s13059-018-1393-5
 )
)
- Marcus JH, Posth C, Ringbauer H, Lai L, Skeates R, Sidore C, Beckett J, Furtwängler A, Olivieri A, Chiang CW, Al-Asadi H, Dey K, Joseph TA, Liu CC, Der Sarkissian C, Radzevičiūtė R, Michel M, Gradoli MG, Marongiu P, Rubino S, Mazzarello V, Rovina D, La Fragola A, Serra RM, Bandiera P, Bianucci R, Pompianu E, Murgia C, Guirguis M, Orquin RP, Tuross N, van Dommelen P, Haak W, Reich D, Schlessinger D, Cucca F, Krause J, Novembre J, « Genetic history from the Middle Neolithic to present on the Mediterranean island of Sardinia », Nature Communications, vol. 11, no 1, , p. 939 (PMID 32094358, PMCID 7039977, DOI 10.1038/s41467-020-14523-6, Bibcode 2020NatCo..11..939M)
- (en) Iain Mathieson, The genomic history of southeastern Europe, nature.com, Nature, volume 555, pages 197–203, 2018
- L.G. Simões et al., « Northwest African Neolithic initiated by migrants from Iberia and Levant », Nature, vol. 618, no 7965, , p. 550–556 (PMID 37286608, PMCID 10266975, DOI 10.1038/s41586-023-06166-6, Bibcode 2023Natur.618..550S)
Voir aussi
- Haplogroupe R (Y-ADN)
- Haplogroupe R1a (Y-ADN)
- Haplogroupe R1b1c10
- Haplogroupe I
- R1b-L21
- Haplogroupe H (ADNmt)
- Origines des Basques
|
Haplogroupes du chromosome Y (Y-ADN) | ||||||||||||||||||||||||
| Plus récent ancêtre patrilinéaire commun | ||||||||||||||||||||||||
| A | ||||||||||||||||||||||||
| BT | ||||||||||||||||||||||||
| B | CT | |||||||||||||||||||||||
| DE | CF | |||||||||||||||||||||||
| D | E | C | F | |||||||||||||||||||||
| G | H | IJK | ||||||||||||||||||||||
| IJ | K | |||||||||||||||||||||||
| I | J | LT | K2 | |||||||||||||||||||||
| I1 | L | T | MS | P | NO | |||||||||||||||||||
| M | S | Q | R | N | O | |||||||||||||||||||
| R1 | R2 | |||||||||||||||||||||||
| R1a | R1b | |||||||||||||||||||||||
