Hélice-coude-hélice
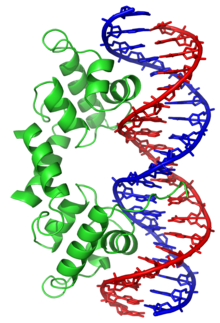
Un domaine hélice-coude-hélice (HTH, ou Helix-Turn-Helix en anglais) est un élément de structure secondaire des protéines et un motif structurel important des protéines de liaison à l'ADN. Distinct du domaine hélice-boucle-hélice avec lequel il ne doit pas être confondu, il est formé de deux hélices α reliées par un court segment fléchi et est présent dans de nombreuses protéines intervenant dans la régulation de l'expression génétique[1]. Son identification résulte de l'observation de similitudes entre des gènes codant les protéines Cro, CAP et répresseur λ de régulation de la transcription chez le phage λ et Escherichia coli, qui se trouvent posséder en commun une séquence de 20 à 25 résidus d'acides aminés facilitant la reconnaissance de l'ADN[2],[3],[4],[5].
Structure et typologies
La structure hélice-coude-hélice est un motif de liaison à l'ADN. Les deux hélices α assurent la reconnaissance et la liaison à l'ADN, l'une à l'extrémité N-terminale et l'autre à l'extrémité C-terminale. Dans la plupart des cas, comme pour le répresseur Cro, c'est la seconde hélice α (côté C-terminal) qui intervient le plus dans la reconnaissance de l'ADN, de sorte qu'on l'appelle hélice de reconnaissance. Elle se lie au grand sillon de l'ADN à travers une série de liaisons hydrogène et d'interaction de Van der Waals avec les bases exposées à ce sillon. L'autre hélice α, côté N-terminal, stabilise l'interaction entre la protéine et l'ADN, mais ne joue pas de rôle particulier dans la reconnaissance de cet ADN[2]. Ces deux hélices partagent toujours la même orientation relative[6].
Il existe plusieurs types de motifs hélice-coude-hélice en fonction de leur structure et de l'arrangement tridimensionnel des hélices[6],[7],[8]. Certains sont décrits ci-dessous :
- À deux hélices — C'est le plus simple de ces motifs. Un homéodomaine enroulé comprenant deux hélices α et le coude a été identifié comme domaine protéique à repliement indépendant ultrarapide[9].
- À trois hélices — On en trouve un exemple dans l'activateur de transcription MYB [10].
- À quatre hélices et plus — Le motif HTH à quatre hélices possède une hélice C-terminale de plus que le motif à trois hélices. On le trouve dans le domaine HTH de liaison à l'ADN de type LuxR des facteurs de transcription bactériens et dans le motif HTH des répresseurs TetR [11]. Il existe également des motifs HTH possédant encore davantage d'hélices[12].
- HTH « ailé » — le motif HTH ailé (wHTH, pour winged helix-turn-helix) est formé d'un faisceau de trois hélices α et d'un feuillet β à trois ou quatre brins formant un aile. La géométrie de ces éléments varie selon les différents motifs wHTH. Celui de la famille des facteurs de transcription ETS , par exemple, est formé d'un motif HTH et d'un feuillet β à quatre brins formant un échafaudage dans l'ordre α1-β1-β2-α2-α3-β3-β4, la troisième hélice étant celle de reconnaissance[13],[14].
- Autres motifs HTH modifiés — Le domaine de liaison à l'ADN du régulateur de résistance aux antibiotiques multiple MarR présente un motif HTH ailé possédant une hélice C-terminale supplémentaire[15].
Références
- ↑ (en) R. G. Brennan et B. W. Matthews, « The helix-turn-helix DNA binding motif », Journal of Biological Chemistry, vol. 264, no 4, , p. 1903-1906 (PMID 2644244, lire en ligne)
- (en) B. W. Matthews, D. H. Ohlendorf, W. F. Anderson et Y. Takeda, « Structure of the DNA-binding region of lac repressor inferred from its homology with cro repressor », Proceedings of the National Academy of Sciences of the United States of America, vol. 79, no 5, , p. 1428-1432 (PMID 6951187, PMCID 345986, DOI 10.1073/pnas.79.5.1428, lire en ligne)
- ↑ (en) W. F. Anderson, D. H. Ohlendorf, Y. Takeda et B. W. Matthews, « Structure of the cro repressor from bacteriophage λ and its interaction with DNA », Nature, vol. 290, no 5809, , p. 754-758 (PMID 6452580, DOI 10.1038/290754a0, lire en ligne)
- ↑ (en) David B. McKay et Thomas A. Steitz, « Structure of catabolite gene activator protein at 2.9 Å resolution suggests binding to left-handed B-DNA », Nature, vol. 290, no 5809, , p. 744-749 (PMID 6261152, DOI 10.1038/290744a0, lire en ligne)
- ↑ (en) Carl O. Pabo et Mitchell Lewis, « The operator-binding domain of λ repressor: structure and DNA recognition », Nature, vol. 289, no 5873, , p. 443-447 (PMID 7088190, DOI 10.1038/298443a0, lire en ligne)
- (en) René Wintjens et Marianne Rooman, « Structural classification of HTH DNA-binding domains and protein-DNA interaction modes », Journal of Molecular Biology, vol. 262, no 2, , p. 294-313 (PMID 8831795, DOI 10.1006/jmbi.1996.0514, lire en ligne)
- ↑ (en) Masashi Suzuki et Steven E. Brenner, « Classification of multi-helical DNA-binding domains and application to predict the DBD structures of σ factor, LysR, OmpR/PhoB, CENP-B, Rap1, and XylS/Ada/AraC », FEBS Letters, vol. 372, nos 2-3, , p. 215-212 (PMID 7556672, DOI 10.1016/0014-5793(95)00988-L, lire en ligne)
- ↑ (en) L. Aravind, Vivek Anantharaman, Santhanam Balaji, M. Mohan Babu et Lakshminarayan M. Iyer, « The many faces of the helix-turn-helix domain: Transcription regulation and beyond », FEMS Microbiology Reviews, vol. 29, no 2, , p. 231-262 (PMID 15808743, DOI 10.1016/j.fmrre.2004.12.008, lire en ligne)
- ↑ (en) Tomasz L. Religa, Christopher M. Johnson, Dung M. Vu, Scott H. Brewer, R. Brian Dyer et Alan R. Fersht, « The helix–turn–helix motif as an ultrafast independently folding domain: The pathway of folding of Engrailed homeodomain », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 22, , p. 9272-9277 (PMID 17517666, PMCID 1890484, DOI 10.1073/pnas.0703434104, lire en ligne)
- ↑ (en) K. Ogata, H. Hojo, S. Aimoto, T. Nakai, H. Nakamura, A. Sarai, S. Ishii et Y. Nishimura, « Solution structure of a DNA-binding unit of Myb: a helix-turn-helix-related motif with conserved tryptophans forming a hydrophobic core », Proceedings of the National Academy of Sciences of the United States of America, vol. 89, no 14, , p. 6428-6432 (PMID 1631139, PMCID 49514, DOI 10.1073/pnas.89.14.6428, lire en ligne)
- ↑ (en) W. Hinrichs, C. Kisker, M. Duvel, A. Muller, K. Tovar, W. Hillen et W. Saenger, « Structure of the Tet repressor-tetracycline complex and regulation of antibiotic resistance », Science, vol. 264, no 5157, , p. 418-420 (PMID 8153629, DOI 10.1126/science.8153629, lire en ligne)
- ↑ (en) Junji Iwahara et Robert T. Clubb, « Solution structure of the DNA binding domain from Dead ringer, a sequence‐specific AT‐rich interaction domain (ARID) », EMBO Press, vol. 18, no 21, , p. 6084-6094 (PMID 10545119, PMCID 1171673, DOI 10.1093/emboj/18.21.6084, lire en ligne)
- ↑ (en) L. W. Donaldson, J. M. Petersen, B. J. Graves et L. P. McIntosh, « Solution structure of the ETS domain from murine Ets-1: a winged helix-turn-helix DNA binding motif », The EMBO Journal, vol. 15, no 1, , p. 125-134 (PMID 8598195, PMCID 449924)
- ↑ (en) Andrew D. Sharrocks, A.Louise Brown, Yan Ling et Paula R. Yates, « The ETS-domain transcription factor family », The International Journal of Biochemistry & Cell Biology, vol. 29, no 12, , p. 1371-1387 (PMID 9570133, DOI 10.1016/S1357-2725(97)00086-1, lire en ligne)
- ↑ (en) Michael N. Alekshun, Stuart B. Levy, Tanya R. Mealy, Barbara A. Seaton et James F. Head, « The crystal structure of MarR, a regulator of multiple antibiotic resistance, at 2.3 Å resolution », Nature Structural Biology, vol. 8, no 8, , p. 710-714 (PMID 11473263, DOI 10.1038/90429, lire en ligne)
